1. Proton
Pada tahun 1910, seorang fisikawan Selandia Baru Ernest Rutherford, yang sebelumnya belajar bersama Thomson di Cambridge University, memutuskan untuk menggunakan partikel α untuk mengetahui struktur atom. Bersama rekannya Hans Geiger dan mahasiswanya yang bernama Ernest Marsden, Rutherford melakukan serangkaian percobaan dengan menggunakan lembaran emas yang sangat tipis dan logam lainnya sebagai sasaran untuk partikel α yang berasal dari sebuah radioaktif (Gambar 2.8). Mereka mengamati bahwa sebagian besar partikel menembus lembaran tanpa membelok atau hanya sedikit membelok. Mereka juga mengamati bahwa ada partikel α yang dihamburkan (atau dibelokkan) dengan sudut yang besar. Pada beberapa kesempatan, partikel α dipantulkan ke arah datangnya! Ini merupakan penemuan yang paling mengejutkan, karena dalam model Thomson muatan positif dari atom sangat tersebar sehingga partikel α yang bermuatan positif diperkirakan menembus dengan sedikit pembelokan. Mengutip tanggapan awal Rutherford ketika menceritakan penemuan ini: “sangat luar biasa, seolah-olah anda menembakkan peluru 15 inci ke selembar kertas tisu dan peluru itu membalik dan mengenai Anda.
Untuk menjelaskan hasil percobaan
hamburan α, Rutherford membuat model baru untuk struktur atom, dengan anggapan
bahwa sebagian besar dari atom pastilah berupa ruang kosong. Struktur ini akan
memungkinkan sebagian besar partikel α menembus lembaran emas dengan sedikit
atau tanpa pembelokkan. Menurut proposisi Ruterford, muatan positif atom
seluruhnya terkumpul dalam inti (nucleus), yaitu suatu
inti pusat yang padat terletak didalam atom. Setiap kali partikel α
mendekat ke inti dalam percobaan hamburan, partikel ini mengalami gaya tolak
yang besar sehingga partikel ini membelok jauh. Bahkan, partikel α yang
langsung menuju inti akan mengalami tolakan yang sangat besar sehingga dapat
berbalik kembali arah datangnya.
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI
Partikel-partikel bermuatan
positif dalam inti disebut proton. Dalam percobaan
yang terpisah, ditemukan bahwa muatan setiap proton mempunyai magnitude
(besar) yang sama dengan elektron bahwa massanya adalah 1,67262 x 10-24
g – sekitar 1840 kali massa elektron, yang muatannya berlawanan.
Pada tahap penyelidikan ini, ilmuwan membayangkan atom
sebagai berikut. Massa inti merupakan bagian terbesar dari massa keseluruhan
atom, tetapi inti menempati hanya sekitar 1/1013 dari volume atom.
Kita menyatakan dimensi atom (dan molekul) dalam satuan SI yang disebut pikometer
(pm), dan 1 pm = 1 x 10-12 m.
Ukuran jari-jari atom
adalah sekitar 100 pm, sedangkan jari-jari inti atom hanya sekitar 5 x 10-3
pm. Anda dapat membayangkan bahwa jika suatu atom seukuran Gelora Senayan, maka
volume intinya akan sebanding dengan ukuran kelereng. Walaupun proton
seluruhnya berada di dalam inti atom, elektron diperkirakan tersebar di sekitar
inti pada jarak tertentu dari inti tersebut.
2. Neutron
Model struktur atom Rutherford menyisakan sebuah masalah
penting yang belum terpecahkan. Telah diketahui bahwa Hidrogen, atom yang
paling sederhana, mengandung hanya satu proton dan bahwa atom helium mengandung
dua proton. Jadi, perbandingan massa atom helium dan atom hidrogen tentunya
adalah 2:1. (karena massa elektron jauh lebih ringan daripada massa proton,
pengaruhnya dapat diabaikan). Tapi dalam kenyataan, perbandingannya adalah 4:1.
Rutherford dan rekan-rekannya
mempostulatkan bahwa pastilah terdapat jenis partikel subatom yang lain dalam
inti atom; pembuktiannya diberikan oleh fisikawan Inggris yang lain, James
Chadwick, pada tahun 1932. Ketika Chadwick menembakkan partikel α ke selembar
tipis berilium, logam tersebut memancarkan radiasi yang berenergi sangat tinggi
yang serupa dengan sinar-γ. Percobaan selanjutnya menunjukkan bahwa sinar itu sesungguhnya
terdiri atas partikel netral yang mempunyai massa sedikit lebih besar
daripada massa proton. Chadwick menamai partikel ini neutron.
Misteri perbandingan massa di atas sekarang
sudah dapat dijelaskan. Dalam inti helium terdapat dua proton dan dua neutron,
tetapi tetapi dalam inti hidrogen hanya terdapat satu proton dan tidak ada
neutron; jadi perbandingannya adalah 4:1. Gambar 2.9 menunjukkan letak dari
partikel-partikel elementer (proton, neutron, dan elektron) di dalam suatu
atom. Terdapat partikel subatom yang lain, tetapi elektron, proton, dan neutron
adalah tiga komponen dasar atom yang penting dalam kimia. Tabel 2.1 menunjukkan
massa dan muatan dari ketiga partikel elementer ini.
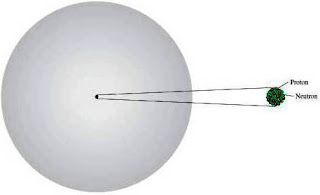 |
| Figure 2.9 The protons and neutrons of an atom are packed in an extremely small nucleus. Electrons are shown as *cloud* around the nucleus. |
Referensi: Raymond Chang




No comments:
Post a Comment