Ketika menggambar struktur Lewis untuk ozon (O3)
aturan oktet untuk atom O pusat dipenuhi dengan menempatkan ikatan rangkap dua
di antara atom O pusat dan salah satu dari dua atom O ujung. Kenyataannya, kita
dapat meletakkan ikatan rangkap dua tersebut pada salah satu ujung molekul,
oleh kedua struktur Lewis yang ekuivalen berikut:
Tetapi, kedua struktur Lewis ini tidak
dapat menjelaskan panjang ikatan yang sudah diketahui dalam O3.
Berdasarkan strukur
di atas, ikatan O—O dalam O3 diperkirakan akan lebih panjang
daripada ikatan O=O, karena ikatan rangkap dua telah diketahui lebih pendek
dibandingkan ikatan tunggal. Tetapi data percobaan menunjukkan bahwa panjang
kedua ikatan oksigen-dengan-oksigen adalah sama panjang (128 pm). Masalah ini
diatasi dengan menggunakan kedua struktur Lewis untuk menyatakan molekul ozon:
Kedua struktur itu masing-masing disebut
sebagai struktur resonansi (resonance structure). Dengan demikian, struktur
resonansi adalah salah satu dari dua atau lebih struktur Lewis untuk satu molekul yang tidak dapat dinyatakan
secara tepat dengan hanya menggunakan satu struktur Lewis. Tanda panah dua
arah menyatakan bahwa struktur-struktur yang diberikan merupakan struktur
resonansi.
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI
Istilah resonansi
berarti penggunaan dua atau lebih
struktur Lewis untuk menggambarkan molekul tertentu. Seperti seorang Eropa
pada abad pertengahan yang melakukan perjalanan ke Afrika, yang menjelaskan
bahwa badak adalah hasil persilangan antara griffin
dan unicorn, dua binatang yang
terkenal tetapi hanya khayalan, kita menggambarkan ozon yang merupakan molekul
nyata, dalam dua struktur yang terkenal tetapi tidak nyata.
Resonansi sering
disalahartikan dengan mengatakan bahwa molekul seperti ozon berpindah-pindah
secara cepat dari struktur resonansi satu ke struktur resonansi yang lain.
Harus diingat bahwa tidak satu pun dari
struktur resonansi yang diberikan dapat menggambarkan secara tepat struktur
molekul yang sesungguhnya, yang merupakan struktur tersendiri yang unik dan
stabil. “Resonansi” adalah ciptaan manusia, yang disusun untuk mengatasi
keterbatasan model ikatan yang sederhana ini. Contoh lain dari resonansi adalah
ion karbonat,
Berdasarkan data percobaan, semua ikatan
karbon-dengan-oksigen dalam CO32- sama panjang (identik),
sehingga sifat-sifat ion karbonat akan lebih baik dijelaskan dalam menggunakan
ketiga struktur resonansi di atas.
Konsep resonansi juga berlaku dengan
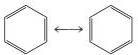
baik untuk senyawa-senyawa organik. Contoh yang baik adalah molekul benzena (C6H6):
Jika salah satu dari struktur resonansi
di atas terkait dengan struktur benzena yang sesungguhnya, maka akan terdapat
dua panjang ikatan yang berbeda antara atom-atom C yang berdekatan, satu ikatan
dengan panjang ikatan yang khas untuk ikatan tunggal dan satu ikatan dengan
panjang ikatan yang khas untuk ikatan rangkap dua. Kenyataannya, semua atom C
yang berdekatan pada benzena panjanganya 140 pm, yang lebih pendek dari ikatan
tunggal, C—C (154 pm) dan lebih panjang dari ikatan rangkap dua , C=C (133 pm).
Cara sederhana untuk
menggambarkan struktur molekul benzena dan senyawa lain yang mengandung “cincin
benzena” adalah dengan menggambarkan hanya kerangkanya saja tanpa atom C dan H.
Berdasarkan kesepakatan ini, struktur resonansinya digambarkan dengan:
Perhatikan bahwa atom-aton C di setiap
sudut segi enam tersebut dan atom-atom H yang ada tidak ditunjukkan, walaupun
sebenarnya atom-atom tersebut ada. Hanya ikatan antara atom-atom yang
ditunjukkan.
Harap diingat ini
merupakan anatara penting untuk menggambarkan struktur resonansi: Posisi
elektron dapat diubah-ubah untuk menghasilkan struktur resonansi yang lain,
tanpa mengubah posisi atom-atomnya. Dengan kata lain, atom-atom yang saling
berikatan harus tetap dalam semua struktur resonansi untuk satu spesi tertentu.
Akhirnya, perhatikan
bahwa walaupun suatu ion atau senyawa dapat digambarkan secara lebih akurat
dengan menyertakan semua struktur resonansinya, tetapi supaya sederhana
biasanya hanya satu struktur Lewis saja yang dipergunakan.
Referensi: Raymond Chang


Mantap
ReplyDeleteMantul
ReplyDeleteMantul
ReplyDelete